jueves, 26 de noviembre de 2009
¿Qué hacer con la glicerina procedente de las plantas de biodiésel?
En la actualidad, la glicerina se produce principalmente como producto secundario de la industria oleoquímica (65 %). De hecho, la glicerina constituye el subproducto más importante de esta industria, (aproximadamente el 10 % de su producción total), lo que aumenta la rentabilidad de los procesos oleoquímicos.
Por otra parte, la producción de biodiésel en la Unión Europea ha aumentado exponencialmente en los últimos años hasta alcanzar un valor de 1.7 millones de toneladas, lo que representa el 90 % de la producción mundial. Aunque esta cifra es todavía poco significativa, el precio de la glicerina ha disminuido considerablemente. Asimismo, el porcentaje de sustitución de los biocarburantes en la Unión Europea debe aumentar del 2 % actual al 5.75 % en el año 2010, según la Directiva 2003/30/CE. En este sentido, se estima que en los próximos años habrá un gran excedente de glicerina a menor precio en Europa, lo que puede reducir la competitividad de la industria oleoquímica europea frente a la asiática.
Ante esta situación y la perspectiva de futuro, existe una necesidad urgente de encontrar nuevas aplicaciones para la glicerina. Aunque la glicerina puede aprovecharse energéticamente como combustible, resulta más ventajoso transformarla en productos de alto valor añadido. Así, a partir de la fermentación, la oxidación catalítica, la esterificación selectiva etc. de la glicerina, se pueden producir derivados de la misma con aplicaciones como detergentes, aditivos alimentarios, productos cosméticos, lubricantes etc. La producción de hidrógeno por reformado de la glicerina en fase acuosa también se está investigando en la actualidad. Sin embargo, una de las alternativas más recientes y más interesantes, consiste en la transformación de la glicerina en productos que puedan sustituir parcialmente al gasóleo de automoción, por lo que pueden considerarse, a su vez, biodiésel y, por lo tanto, su utilización contribuye a alcanzar los objetivos de la Directiva Europea 2003/30/CE. En este contexto, la glicerina puede transformarse en dos tipos de productos diferentes: éteres de glicerina, a partir de su eterificación con olefinas ligeras; o ésteres de glicerina, a partir de su esterificación con ácidos carboxílicos o su transesterificación con ésteres.
domingo, 22 de noviembre de 2009
Variables que afectan al proceso de producción de biodiésel
- Acidez y humedad
Los contenidos de ácidos grasos y de humedad son los parámetros determinantes de la viabilidad del proceso de transesterificación del aceite vegetal. Para que se realice la reacción completa se necesita un valor de ácidos grasos libres, menor al 3%. Cuanto más alta es la acidez del aceite, menor es la conversión. Además, tanto el exceso como la deficiencia de catalizador pueden producir la formación de jabón. Como se ha comentado, la presencia de humedad disminuye el rendimiento de la reacción, pues el agua reacciona con los catalizadores formando jabones.
Igualmente, el proceso de catálisis ácida también se puede usar para la esterificación de estos ácidos grasos. Las materias primas usadas como base para el proceso de alcoholisis deben cumplir ciertas especificaciones. Los triglicéridos deben tener un valor ácido bajo y los materiales deben contener baja humedad. La adición de catalizadores de hidróxido de sodio compensa la alta acidez, pero el jabón resultante provoca un aumento de viscosidad o de formación de geles que interfieren en la reacción y en la separación del glicerol. Cuando no se dan estas condiciones los rendimientos de la reacción se reducen sustancialmente.
Actualmente, la mayor parte del biodiésel producido, procede de aceites vegetales al que se le añade metanol y un catalizador alcalino. Sin embargo hay muchos aceites de bajo costo y grasas animales que pueden ser utilizados. Su problema radica en que suelen contener gran cantidad de ácidos grasos que no se pueden convertir en biodiésel usando catalizadores alcalinos. En estos casos es necesario hacer la esterificación en dos etapas: inicialmente debe realizarse un pretratamiento para convertir los ácidos grasos libres en ésteres metílicos con un catalizador ácido, y en un segundo paso se realiza la transesterificación con un catalizador alcalino, para completar la reacción.
- Tipo de catalizador y concentración
Los catalizadores empleados para la transterificación de los triglicéridos se pueden clasificar en alcalinos, ácidos, enzimáticos o catalizadores heterogéneos, siendo los básicos y en particular los hidróxidos los más utilizados. Si el aceite usado tiene un alto grado de ácidos grasos y elevada humedad los catalizadores ácidos son los más adecuados. Estos ácidos pueden ser sulfúrico, fosfórico o ácido sulfónico orgánico. La metanólisis del sebo de animal se ha estudiado con NaOH y NaOMe. Comparando los dos catalizadores, el NaOH ha producido mejores resultados que el NaOMe. El metóxido de sodio provoca la formación de muchos subproductos, principalmente sales de sodio, que deben eliminarse posteriormente.
En los procesos de metanólisis alcalina los principales catalizadores usados han sido el hidróxido potásico y el hidróxido sódico, ambos en concentraciones de 0.4 a 2% v/v de aceite. Aceites, tanto refinados como crudos, con un 1% de catalizador (tanto hidróxido sódico o potásico) han tenido muy buenos resultados. La metanólisis del aceite de soja ha producido sus mejores resultados de rendimiento y viscosidad con una concentración de 1% de hidróxido potásico.
La actividad catalítica ácida se ha estudiado también con aceites vegetales reutilizados. Se han utilizado cuatro concentraciones 0,5, 1, 1,5 y 2,25 M de HCl y los resultados se han comparado con una concentración de 2,25 M H2SO4, obteniendo una mejor actividad catalítica con el ácido sulfúrico en un rango de 1,5-2,25 M de concentración. Aunque el proceso de transesterificación, con catalizadores alcalinos, para transformar los triglicéridos en sus correspondientes ésteres metílicos tiene una conversión muy alta en un periodo más corto de tiempo, tiene algunos inconvenientes: el catalizador debe ser separado del producto final, la recuperación del glicerol puede resultar difícil, el agua alcalina resultante del proceso debe ser tratada y los ácidos grasos y el agua afectan a la reacción.
Los catalizadores enzimáticos pueden obtener resultados relevantes en sistemas tanto acuosos como no acuosos, lo que resuelve alguno de los problemas anteriores. En particular el glicerol se puede separar fácilmente y, también, los ácidos grasos contenidos en el aceite reutilizado se pueden convertir completamente en esteres alquílicos. En cambio el uso de estos catalizadores enzimáticos tiene un coste superior que el de los alcalinos.
- Relación molar de alcohol / aceite y tipo de alcohol
Una de las variables más importantes que afectan al rendimiento del proceso es la relación molar del alcohol y los triglicéridos. La relación estequiométrica requiere tres moles de alcohol y un mol de triglicérido para producir tres moles de ésteres y un mol de glicerol. La transesterificación es una reacción de equilibrio que necesita un exceso de alcohol para conducir la reacción al lado derecho (producción ésteres). Para una conversión máxima se debe utilizar una relación molar de 6:1. En cambio un valor alto de relación molar de alcohol afecta a la separación de glicerina debido al incremento de solubilidad. Cuando la glicerina se mantiene en la solución hace que la reacción revierta hacia la izquierda (reacción reversible), disminuyendo el rendimiento de los ésteres.
La formación de éster etílico comparativamente es más difícil que la de éster metílico, especialmente la formación de una emulsión estable durante la etanólosis es un problema. El etanol y el metanol no se disuelven con los triglicéridos a temperatura ambiente y la mezcla debe ser agitada mecánicamente para que haya transferencia de masa. Durante la reacción generalmente se forma una emulsión, en la metanólosis esta emulsión desciende rápidamente formándose una capa rica en glicerol quedándose en la parte superior otra zona rica en éster metílico (biodiésel). En cambio en la etanólisis esta emulsión no es estable y complica mucho la separación y purificación de los ésteres etílicos. La emulsión está causada en parte por la formación de monoglicéricos y diglicéricos intermedios, que contienen tanto grupos hidróxidos polares como cadenas de hidrocarburos no polares.
- Efecto del tiempo de reacción y temperatura
La conversión aumenta con el tiempo de reacción. Así, Feedman y otros investigadores realizaron la transesterificación del aceite de cacahuete, semilla de algodón, girasol y soja con una relación molar de 6:1 de metanol, con un catalizador de metóxido sódico al 0.5% a 60ºC según el autor. Después de 1 minuto se observó un rendimiento de aproximadamente el 80% para la soja y el girasol, después de una hora la conversión era la misma para los cuatro, con un valor aproximado del 93%.
La transesterificación se puede producir a diferentes temperaturas, dependiendo del tipo de aceite. En el caso de aceite refinado con metanol (6:1) al 1% NaOH, la reacción se estudió a tres temperaturas diferentes. Después de 6 minutos los rendimientos fueron 94%, 87% y 64% para temperaturas de 60, 45 y 32ºC, respectivamente. Después de una hora la formación del éster era idéntica para 60 y 45ºC y ligeramente menor para 32ºC.
sábado, 21 de noviembre de 2009
variables que afectan a la reacción de transesterificación
- Acidez y humedad
Los contenidos de ácidos grasos y de humedad son los parámetros determinantes de la viabilidad del proceso de transesterificación del aceite vegetal. Para que se realice la reacción completa se necesita un valor de ácidos grasos libres menor al 3%. Cuanto más alta es la acidez del aceite, menor es la conversión. Tanto el exceso como la deficiencia de catalizador pueden producir la formación de jabón.
Además, la presencia de humedad disminuye el rendimiento de la reacción, pues el agua reacciona con los catalizadores formando jabones.
Actualmente, la mayor parte del biodiésel producido, procede de aceites vegetales al que se le añade metanol y un catalizador alcalino. Sin embargo hay muchos aceites de bajo costo y grasas animales que pueden ser utilizados. Su problema radica en que suelen contener gran cantidad de ácidos grasos que no se pueden convertir en biodiésel usando catalizadores alcalinos. En estos casos es necesario hacer la esterificación en dos etapas: inicialmente debe realizarse un pretratamiento para convertir los ácidos grasos libres en esteres metílicos con un catalizador ácido, y en un segundo paso se realiza la transesterificación con un catalizador alcalino, para completar la reacción.
- Tipo de catalizador y concentración
Si el aceite usado tiene un alto grado de ácidos grasos y elevada humedad los catalizadores ácidos son los más adecuados.
Aceites, tanto refinados como crudos, con un 1% de catalizador alcalino (tanto hidróxido sódico o potásico) han tenido muy buenos resultados. Sin embargo, el proceso de transesterificación, con dichos catalizadores, para transformar los triglicéridos en sus correspondientes esteres metílicos tiene una conversión muy alta en un periodo más corto de tiempo, tiene algunos inconvenientes: el catalizador debe ser separado del producto final, la recuperación del glicerol puede resultar difícil, el agua alcalina resultante del proceso debe ser tratada y los ácidos grasos y el agua afectan a la reacción.
Los catalizadores enzimáticos pueden obtener resultados relevantes, pero el uso de estos catalizadores tiene un coste superior a los alcalinos.
- Relación molar de alcohol / aceite y tipo de alcohol
La relación estequiométrica requiere tres moles de alcohol y un mol de triglicérido para producir tres moles de ésteres y un mol de glicerol. La transesterificación es una reacción de equilibrio que necesita un exceso de alcohol para conducir la reacción al lado derecho (producción ésteres). Para una conversión máxima se debe utilizar una relación molar de 6:1. En cambio un valor alto de relación molar de alcohol afecta a la separación de glicerina debido al incremento de solubilidad.
La formación de éster etílico comparativamente es más difícil que la de éster metílico, especialmente la formación de una emulsión estable durante la etanólosis es un problema, lo que complica mucho la separación y purificación de los ésteres etílicos
- Efecto del tiempo de reacción y temperatura
La conversión de la reacción de transesterificación aumenta con el tiempo de reacción y se puede producir a diferentes temperaturas, dependiendo del tipo de aceite utilizado.
lunes, 16 de noviembre de 2009
Proceso continuo y reacciones
domingo, 15 de noviembre de 2009
Materias primas y reacciones del biodiesel
¿Cómo se fabrica el biodiesel?
El Biodiesel se produce gracias a una reacción química denominada transesterificación, lo que significa que el glicerol contenido en los aceites es sustituido por un alcohol ante la presencia de un catalizador. En nuestro caso utilizaremos Metanol y NaOH (soda cáustica) o KOH (hidróxido de potasio). Este es sólo un método posible para la elaboración de biodiesel, pero existen otras formas y trucos para preparar biodiesel de buena calidad. Puede encontrar más sobre esto en otros sitios relacionados con este interesante tema.
Los 3 Ingredientes Necesarios
Aceite
El primer ingrediente es el aceite o la grasa. El aceite vegetal que puede tratarse como desecho en la mayoría de los hogares o que puede recolectarse gratis de muchos restaurantes.
Uno puede, por supuesto, plantar girasol o soja y luego de cosecharlo, prensarlo para extraer el aceite, como sucede en muchos lugares del mundo donde se produce el biodiesel.
Muchos productores rurales están convirtiéndose actualmente en económicamente independientes con respecto a la energía. Utilizan biodiesel en tractores y otra maquinarias agrícolas y muchas veces se utilizan los excedentes de biodiesel para generar electricidad.
Las personas que preparan biodiesel en una escala más grande son capaces de utilizar la grasa usada de freír, aceite de pescado, grasa animal y otras clases de aceites. Una ventaja acerca de la elaboración de biodiesel es que se puede hacer de muchas sustancias diferentes, en su mayor parte, desechos.
Alcohol
El segundo ingrediente es el alcohol. El Metanol se usa generalmente para la elaboración con aceites vegetales reciclados. Cuando se utilizan aceites nuevos, es posible la mezcla con etanol.
Hay que aclarar que tanto el metanol como el etanol son materiales muy peligrosos. Hay que evitar inhalarlo y el contacto con la piel y los ojos. Siempre utilice guantes aptos para la manipulación de estas sustancias, protectores para los ojos y máscara para la cara, además de trabajar siempre en lugares bien ventilados.
Catalizador
El último ingrediente es el catalizador. Se pueden utilizar tanto el KOH (hidróxido de potasio) como el NaOH (hidróxido de sodio o soda caustica). La ventaja del KOH es que la glicerina que queda del proceso es mucho menos tóxica que cuando se utiliza NaOH. En este caso, es posible procesar la glicerina para producir un fertilizante artificial. El KOH tiene también la ventaja de que se disuelve mucho mejor en metanol. Sin embargo, la ventaja del NaOH es que es muy simple y barato de conseguir porque se lo utiliza normalmante como destapador de cañerías y a su vez es fácil de manipular.
Asegúrese de utilizar NaOH con una pureza de por lo menos el 96%. El KOH de esa pureza es bastante dificil de encontrar, pero uno de entre el 92% y el 85% puede funcionar bien. Ambos, el NaOH y el KOH son químicos muy peligrosos. Hay que tomar precauciones cuando se utilizan estos químicos.
Reacciones de trasesterificación de triglicéridos
Aunque la esterificación es un proceso posible, sin embargo el método utilizado comercialmente para la obtención de biodiésel es la transesterificación (también llamada alcohólisis).
Se basa en la reacción de moléculas de triglicéridos (el número de átomos de las cadenas está comprendido entre 15 y 23, siendo el más habitual de 18) con alcoholes de bajo peso molecular (metanol, etanol, propanol, butanol) para producir ésteres y glicerina (que puede ser utilizada en cosmética, alimentación, farmacia, etc.).
La reacción de transesterificación, que se presenta en la gráfica 1, se desarrolla en una proporción molar de alcohol a triglicérido de 3 a 1, reaccionando en la metanólisis 1 mol de triglicérdo con 3 moles de alcohol (aunque se añade una cantidad adicional de alcohol para desplazar la reacción hacia la formación del éster metílico). El triglicérido es el principal componente del aceite vegetal o la grasa animal. Además, la formación de la base de la glicerina, inmiscible con los ésteres metílicos, juega un papel importante en el desplazamiento de la reacción hacia la derecha, alcanzándose conversiones cercanas al 100%.

Gráfica 1. Reacción de transesterificación.
En la grafica 2 se presentan las diferentes reacciones que tienen lugar en la transesterificación, la cual consiste químicamente en tres reacciones reversibles y consecutivas. El triglicérido es convertido consecutivamente en diglicérido, monoglicérido y glicerina. En cada reacción un mol de éster metílico es liberado.



En la reacción de transesterificación se utiliza un catalizador para mejorar la velocidad de reacción y el rendimiento final, amén que sin él no sería posible esta reacción. Los catalizadores pueden ser ácidos homogéneos (H2SO4, HCl, H3PO4, RSO3), ácidos héterogeneos (Zeolitas, Resinas Sulfónicas, SO4/ZrO2, WO3/ZrO2), básicos heterogéneos (MgO, CaO, Na/NaOH/Al2O3), básicos homogéneos (KOH, NaOH) o enzimáticos (Lipasas: Candida, Penicillium, Pseudomonas); de todos ellos, los catalizadores que se suelen utilizar a escala comercial son los catalizadores homogéneos básicos ya que actúan mucho más rápido y además permiten operar en condiciones moderadas. En el caso de la reacción de transesterificación, cuando se utiliza un catalizador ácido se requieren condiciones de temperaturas elevadas y tiempos de reacción largos, por ello es frecuente la utilización de derivados de ácidos más activos.
Sin embargo, la utilización de álcalis, que como se ha comentado es la opción más utilizada a escala industrial, implica que los glicéridos y el alcohol deben ser anhidros (<0,06>
 Figura 3. Reacción de saponificación.
Figura 3. Reacción de saponificación.
La saponificación está favorecida cuando se utiliza el hidróxido potásico o sódico, ya que sus moléculas contienen los grupos OH responsables de esta reacción. Así, cuando se utilizan estos catalizadores, se debe tener especial precaución con las condiciones de reacción, especialmente la temperatura y la cantidad de catalizador básico, para reducir al máximo la saponificación. Sin embargo, los metóxidos sólo contienen el grupo OH como impureza, por lo que su utilización no produce prácticamente jabones por saponificación.
En cualquier caso, se deben utilizar aceites y alcoholes esencialmente anhídros, ya que el agua favorece la formación de jabones por saponificación. Por este motivo, se debe eliminar el agua, mediante evaporación, en los aceites con altos contenidos en humedad antes de llevar a cabo la transesterificación.
Por otra parte, hay dos maneras de eliminar los ácidos grasos libres presentes en el aceite. Así, se puede proceder a su neutralización, ya que los ácidos grasos presentes en el aceite vegetal pueden reaccionar con el catalizador básico (fundamentalmente NaOH) en presencia de agua, ocurriendo asimismo una reacción indeseable, produciendo como en el caso anterior jabón, tal y como se puede ver en la gráfica 4.
Otra manera de eliminar los ácidos grasos libres es mediante una reacción de esterificación con un catalizador ácido con lo que se formaría el éster metílico.
 Figura 4. Reacción de neutralización de ácidos grasos libres.
Figura 4. Reacción de neutralización de ácidos grasos libres.Reacciones de esterificación de ácidos grasos
El proceso que se utiliza para la producción de biodiésel es la transesterificación, sin embargo la esterificación se viene aplicando combinándolo con la transesterificación de cara a aprovechar el subproducto de ácidos grasos y producir asimismo biodiésel.
Dada la importancia de los ésteres se han desarrollado numerosos procesos para obtenerlos. El más común es el calentamiento de una mezcla del alcohol y del ácido correspondiente con ácido sulfúrico, utilizando el reactivo más económico en exceso para aumentar el rendimiento y desplazar el equilibrio hacia la derecha (esterificación de Fischer). El ácido sulfúrico sirve en este caso tanto de catalizador como de sustancia higroscópica que absorbe el agua formada en la reacción. A veces es sustituido por ácido fosfórico concentrado.
En la práctica este procedimiento tiene varios inconvenientes. El alcohol puede sufrir reacciones de eliminación formando olefinas, esterificación con el propio ácido sulfúrico o de formación del éter, y el ácido orgánico puede sufrir decarboxilación.
La reacción de esterificación aparece desarrollada en la gráfica 5.
 Figura 5. Reacción de esterificación.
Figura 5. Reacción de esterificación.
Los catalizadores que se utilizan en este tipo de reacción, al contrario que en el proceso de transesterificación que habitualmente son hidróxidos, son ácidos o enzimáticos. En el caso de la esterificación, al contrario que en la reacción de transesterificación, al utilizar catalizadores ácidos no es necesario recurrir a trabajar con temperaturas elevadas y tiempos de reacción largos.
viernes, 13 de noviembre de 2009
ESTERIFICACIÓN

El proceso que se utiliza para la producción de biodiésel es la transesterificación, sin embargo la esterificación se viene aplicando combinándolo con la transesterificación de cara a aprovechar el subproducto de ácidos grasos y producir asimismo biodiésel.
Dada la importancia de los ésteres se han desarrollado numerosos procesos para obtenerlos. El más común es el calentamiento de una mezcla del alcohol y del ácido correspondiente con ácido sulfúrico, utilizando el reactivo más económico en exceso para aumentar el rendimiento y desplazar el equilibrio hacia la derecha (esterificación de Fischer). El ácido sulfúrico sirve en este caso tanto de catalizador como de sustancia higroscópica que absorbe el agua formada en la reacción. A veces es sustituido por ácido fosfórico concentrado.
En la práctica este procedimiento tiene varios inconvenientes. El alcohol puede sufrir reacciones de eliminación formando olefinas, esterificación con el propio ácido sulfúrico o de formación del éter, y el ácido orgánico puede sufrir decarboxilación.
Los catalizadores que se utilizan en este tipo de reacción, al contrario que en el proceso de transesterificación que habitualmente son hidróxidos, son ácidos o enzimáticos. En el caso de la esterificación, al contrario que en la reacción de transesterificación, al utilizar catalizadores ácidos no es necesario recurrir a trabajar con temperaturas elevadas y tiempos de reacción largos.
REACCIÓN DE SAPONIFICACIÓN
La reacción de saponificación se produce cuando el triglicérido reacciona con el catalizador básico, consumiendo éste en presencia de agua dando lugar a la formación de jabones.

Por otra parte, hay dos maneras de eliminar los ácidos grasos libres presentes en el aceite:
1. Mediante la primera forma, se puede proceder a su neutralización, ya que los ácidos grasos presentes en el aceite vegetal pueden reaccionar con el catalizador básico (fundamentalmente NaOH) en presencia de agua, ocurriendo asimismo una reacción indeseable, produciendo como en el caso anterior jabón.
2. Otra manera de eliminar los ácidos grasos libres es mediante una reacción de esterificación con un catalizador ácido con lo que se formaría el éster metílico.
jueves, 12 de noviembre de 2009
El problema de los catalizadores
En la reacción de transesterificación, como ya hemos comentado, se utiliza un catalizador para mejorar la velocidad de reacción y el rendimiento final. Los catalizadores pueden ser ácidos homogéneos (H2SO4, HCl, H3PO4, RSO3), ácidos héterogeneos (Zeolitas, Resinas Sulfónicas, SO4/ZrO2, WO3/ZrO2), básicos heterogéneos (MgO, CaO, Na/NaOH/Al2O3), básicos homogeneos (KOH, NaOH) o enzimáticos (Lipasas: Candida, Penicillium, Pseudomonas); de todos ellos, los catalizadores que se suelen utilizar a escala comercial son los catalizadores homogéneos básicos ya que actúan mucho más rápido y además permiten operar en condiciones moderadas. En el caso de la reacción de transesterificación, cuando se utiliza un catalizador ácido se requieren condiciones de temperaturas elevadas y tiempos de reacción largos, por ello es frecuente la utilización de derivados de ácidos más activos.
Sin embargo, la utilización de álcalis, que como se ha comentado es la opción más utilizada a escala industrial, implica que los glicéridos y el alcohol deben ser anhidros (<0,06>
De esta manera las reacciones secundarias que se pueden dar son las siguientes:
· Reacción de saponificación
· Reacción de neutralización de Ácidos grasos libres
El triglicérido reacciona con el catalizador básico, consumiendo éste, en presencia de agua dando lugar a la formación de jabones (reacción de saponificación), tal y como se puede ver abajo.

Reacción de saponificación.
La saponificación está favorecida cuando se utiliza el hidróxido potásico o sódico, ya que sus moléculas contienen los grupos OH responsables de esta reacción. Así, cuando se utilizan estos catalizadores, se debe tener especial precaución con las condiciones de reacción, especialmente la temperatura y la cantidad de catalizador básico, para reducir al máximo la saponificación. Sin embargo, los metóxidos sólo contienen el grupo OH como impureza, por lo que su utilización no produce prácticamente jabones por saponificación.
En cualquier caso, se deben utilizar aceites y alcoholes esencialmente anhídros, ya que el agua favorece la formación de jabones por saponificación. Por este motivo, se debe eliminar el agua, mediante evaporación, en los aceites con altos contenidos en humedad antes de llevar a cabo la transesterificación.
Por otra parte, hay dos maneras de eliminar los ácidos grasos libres presentes en el aceite. Así, se puede proceder a su neutralización, ya que los ácidos grasos presentes en el aceite vegetal pueden reaccionar con el catalizador básico (fundamentalmente NaOH) en presencia de agua, ocurriendo asimismo una reacción indeseable, produciendo como en el caso anterior jabón, tal y como se puede ver abajo.
Otra manera de eliminar los ácidos grasos libres es mediante una reacción de esterificación con un catalizador ácido con lo que se formaría el éster metílico.

Reacción de neutralización de ácidos grasos libres.
Reacciones de esterificación de ácidos grasos
El proceso que se utiliza para la producción de biodiésel es la transesterificación, sin embargo la esterificación se viene aplicando combinándolo con la transesterificación de cara a aprovechar el subproducto de ácidos grasos y producir asimismo biodiésel.
Dada la importancia de los ésteres se han desarrollado numerosos procesos para obtenerlos. El más común es el calentamiento de una mezcla del alcohol y del ácido correspondiente con ácido sulfúrico, utilizando el reactivo más económico en exceso para aumentar el rendimiento y desplazar el equilibrio hacia la derecha (esterificación de Fischer). El ácido sulfúrico sirve en este caso tanto de catalizador como de sustancia higroscópica que absorbe el agua formada en la reacción. A veces es sustituido por ácido fosfórico concentrado.
En la práctica este procedimiento tiene varios inconvenientes. El alcohol puede sufrir reacciones de eliminación formando olefinas, esterificación con el propio ácido sulfúrico o de formación del éter, y el ácido orgánico puede sufrir decarboxilación.
La reacción de esterificación aparece desarrollada abajo.

Reacción de esterificación.
Los catalizadores que se utilizan en este tipo de reacción, al contrario que en el proceso de transesterificación que habitualmente son hidróxidos, son ácidos o enzimáticos. En el caso de la esterificación, al contrario que en la reacción de transesterificación, al utilizar catalizadores ácidos no es necesario recurrir a trabajar con temperaturas elevadas y tiempos de reacción largos.
Reacción de transesterificación
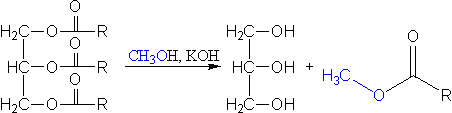
Como ya sabemos, el biodiésel es una mezcla de ésteres metílicos de ácidos grasos (R-COOCH3) y como sabemos también, estos se obtienen de grasas y aceites (acilglicéridos). La reacción que tiene lugar para convertir los reactivos en productos se llama transesterificación, y consiste en la combinación de las grasas y aceites con un alcohol ligero, metanol por ejemplo, obteniéndose glicerina y ésteres metílicos de ácidos grasos como podemos ver en la imagen superior.
1. Proceso base-base, mediante el cual se utiliza como catalizador un hidróxido. Este hidróxido puede ser hidróxido de sodio (soda cáustica) o hidróxido de potasio (potasa cáustica).
2. Proceso ácido-base. Este proceso consiste en hacer primero una esterificación ácida y luego seguir el proceso normal (base-base), se usa generalmente para aceites con alto índice de acidez.
3. Procesos supercríticos. En este proceso ya no es necesario la presencia de catalizador, simplemente se hacen a presiones elevadas en las que el aceite y el alcohol reaccionan sin necesidad de que un agente externo actúe en la reacción.
4. Procesos enzimáticos. En la actualidad se están investigando algunas enzimas que puedan servir como aceleradores de la reacción aceite-alcohol. Este proceso no se usa en la actualidad debido a su alto coste, el cual impide que se produzca biodiésel en grandes cantidades.
5. Método de reacción Ultrasónica
En el método reacción ultrasonica, las ondas ultrasónicas causan que la mezcla produzca y colapse burbujas constantemente. Esta cavitación proporciona simultáneamente la mezcla y el calor necesarios para llevar a cabo el proceso de transesterificación. Así, utilizando un reactor ultrasónico para la producción del biodiésel, se reduce drásticamente el tiempo, temperatura y energía necesaria para la reacción. Y no sólo reduce el tiempo de proceso sino también de separación. De ahí que el proceso de transesterificación puede correr en línea en lugar de utilizar el lento método de procesamiento por lotes. Los dispositivos ultrasonicos de escala industrial permiten el procesamiento de varios miles de barriles por día. Especialmente durante el último año el uso del equipo ultrasónico aumentaba significamente a causa de sus ventajas económicas.
martes, 10 de noviembre de 2009
Las reacciones del biodiesel
El primero es a tamaño molecular, nos muestra la saponificación y la transesterificación típicas del biodiesel
En el segundo se observa cómo producir el biodiesel en un laboratorio
domingo, 8 de noviembre de 2009
Reacción de transesterificación
Se basa en la reacción de moléculas de triglicéridos (con un número de carbonos por cadena comprendido entre 15 y 23, siendo la más habitual de 18) con alcoholes de bajo peso molecular (metanol, etanol, propanol, butanol) para producir ésteres y glicerina (que puede ser utilizada en cosmética, alimentación, farmacia, etc.).
La reacción de transesterificación, se desarrolla en una proporción molar de alcohol a triglicérido de 3 a 1, reaccionando en la metanólisis 1 mol de triglicérido con 3 moles de alcohol (aunque se añade una cantidad adicional de alcohol para desplazar la reacción hacia la formación del éster metílico). El triglicérido es el principal componente del aceite vegetal o la grasa animal. Además, la formación de la base de la glicerina, inmiscible con los ésteres metílicos, juega un papel importante en el desplazamiento de la reacción hacia la derecha, alcanzándose conversiones cercanas al 100%.

La transesterificación consiste químicamente en tres reacciones reversibles y consecutivas. El triglicérido es convertido consecutivamente en diglicérido, monoglicérido y glicerina. En cada reacción un mol de éster metílico es liberado.
En la reacción de transesterificación se utiliza un catalizador para mejorar la velocidad de reacción y el rendimiento final, ya que sin él no sería posible esta reacción. Los catalizadores, como comente en entradas anteriores, pueden ser ácidos homogéneos (H2SO4, HCl, H3PO4, R-SO3), ácidos heterogéneos (Zeolitas, Resinas Sulfónicas, SO4/ZrO2, WO3/ZrO2), básicos heterogéneos (MgO, CaO, Na/NaOH/Al2O3), básicos homogéneos (KOH, NaOH) o enzimáticos (Lipasas: Candida, Penicillium, Pseudomonas); de todos ellos, los catalizadores que se suelen utilizar a escala comercial son los catalizadores homogéneos básicos ya que actúan mucho más rápido y además permiten operar en condiciones moderadas. En el caso de la reacción de transesterificación, cuando se utiliza un catalizador ácido se requieren condiciones de temperaturas elevadas y tiempos de reacción largos, por ello es frecuente la utilización de derivados de ácidos más activos.
Sin embargo, la utilización de álcalis implica que los glicéridos y el alcohol deben ser anhidros para evitar que se produzca la saponificación. Además, los triglicéridos deben tener una baja proporción de ácidos grasos libres para evitar que se neutralicen con el catalizador y se formen también jabones.
De esta manera las reacciones secundarias que se pueden dar son las siguientes:
· Reacción de saponificación.
· Reacción de neutralización de Ácidos grasos libres.
sábado, 7 de noviembre de 2009
Reacciones y catalizadores para la obtención del biodiesel
El biodiesel son ésteres monoalquílicos de ácidos grasos de cadena larga derivados de una materia prima lipídica renovable, tales como aceite vegetal o grasa animal. La reacción para su obtención es la transesterificación que consta de tres pasos:
Triglicerido + metanol -> Ester + Diglicérido
La reacción se basa en la reacción de las moléculas de Triglicéridos - Principal componente del Aceite vegetal y animal - con un alcohol de bajo peso molecular, normalmente este suele ser metanol, pero también podemos usar etanol, propanol y butanol.
Normalmente se añade una proporción 1:3, aunque suele echarse algo más del producto alcohol para hacer que la reacción sea completa hacia la derecha. Es también de importancia que suele conseguirse reacciones con un rendimiento que ronda el 100%, por lo que suelen ser reacciones económicas.
Para este tipo de reacciones se utilizan catalizadores para aumentar el rendimiento de la reacción. Los tipos de catalizadores utilizados son: ácidos (ácido sulfúrico, ácido sulfónico y ácido clorhídrico), alcalinos (hidróxido de sodio, metóxido de sodio, hidróxido de potasio, metóxido de potasio y carbonatos) y enzímaticos(lipasas).
La transesterificación en fase homogénea con catalizadores alcalinos es más rápida y las condiciones de reacción son moderadas con respecto a los ácidos. Pero su uso en la transesterificación de aceites vegetales produce jabón por neutralización de los ácidos grasos libres y la saponificación de los triglicéridos.
La reacción de saponificaión es la siguiente:
CH3-(CH2)-COO-CH2-R + NaOH ----> CH3-(CH2)n- COONa + OH-CH2-R
éster jabón alcohol
Lo cual consume parcialmente el catalizador, disminuye el rendimiento y dificulta la separación y purificación del biodiesel. Por ello los Glicéridos y Alcoholes han de ser anhídridos con menos de un 0,06% en relación v/v, ya que de esta forma se evita que se creen reacciones de saponificación al tratar los glicéridos con alcohol y el catalizador básico.
El otro problema del uso de catalizadores es la reacción de los Acidos grasos libres que se encuentran en el Aceite con el catalizador formando lo que no queremos que se forme, un Jabón potásico, por lo que se aprovechan para la creación de biodiesel mediante las reacciones de esterificación.
Las reacciones de "Esterificación" consisten en:
Ácido graso + metanol -> Ester métilico + Agua
En este caso, los catalizadores suelen ser ácidos o enzimáticos, ya que al contrario que la transesterificación, no es necesario recurrir a tiempos largos de proceso ni altas temperaturas, cosa que sí ocurriría si en una reacción de transferificación usaramos estos catalizadores.
martes, 3 de noviembre de 2009
Los ingredientes y su tratamiento.
 Los catalizadores que se suelen utilizar a escala comercial son los catalizadores homogéneos básicos ya que actúan mucho más rápido y además permiten operar en condiciones moderadas.
Los catalizadores que se suelen utilizar a escala comercial son los catalizadores homogéneos básicos ya que actúan mucho más rápido y además permiten operar en condiciones moderadas.
El triglicérido reacciona con el catalizador básico, consumiendo éste, en presencia de agua dando lugar a la formación de jabones (reacción de saponificación), Posteriormente se plantea una reacción de saponificación y una esterificación de ácidos grasos. En la práctica este procedimiento tiene varios inconvenientes. El alcohol puede sufrir reacciones de eliminación formando olefinas, esterificación con el propio ácido sulfúrico o de formación del éter, y el ácido orgánico puede sufrir decarboxilación.
Posteriormente se plantea una reacción de saponificación y una esterificación de ácidos grasos. En la práctica este procedimiento tiene varios inconvenientes. El alcohol puede sufrir reacciones de eliminación formando olefinas, esterificación con el propio ácido sulfúrico o de formación del éter, y el ácido orgánico puede sufrir decarboxilación.
Los catalizadores que se utilizan en la reacción de esterificación, al contrario que en el proceso de transesterificación que habitualmente son hidróxidos, son ácidos o enzimáticos. En el caso de la esterificación, al contrario que en la reacción de transesterificación, al utilizar catalizadores ácidos no es necesario recurrir a trabajar con temperaturas elevadas y tiempos de reacción largos.
lunes, 2 de noviembre de 2009
Nuevos catalizadores

Una manera de reducir el costo para la producción de biodiesel es utilizar materias primas baratas, como los aceites de desecho de restaurantes o grasas de rastros, pero es necesario utilizar un catalizador que no produzca jabón como resultado de la reacción química con los ácidos grasos, pues de lo contrario no pueden convertirse en biodiesel.
Por ello, en lugar del catalizador químico que se utiliza convencionalmente, se ha optado por utilizar catalizadores biológicos o enzimas, específicamente las denominadas lipasas, las cuales son potencialmente más útiles que los catalizadores químicos, ya que son más compatibles con las variaciones de calidad de las materias primas y pueden ser reutilizadas; son capaces de producir el biodiesel con un menor número de etapas -lo cual implica el uso de menos energía y reducción significativa de la cantidad de agua de desecho-, además de que permiten mejorar la separación del biodiesel y obtener un mejor rendimiento y calidad del glicerol.
Con el propósito de elaborar un biodiesel de la mejor calidad posible, actualmente evalúan la acción de lipasas provenientes de distintas bacterias, las cuales tienen alta capacidad de transformar los aceites y grasas de desecho.
